Úvod do Světa Elektrochemických Metod Měření
Elektrochemické metody měření představují základní a nepostradatelný nástroj v mnoha vědeckých a průmyslových odvětvích. Využívají principů chemických reakcí, které probíhají na rozhraní elektrody a elektrolytu, a převádějí chemickou informaci na měřitelný elektrický signál. Tato transformace umožňuje citlivou a selektivní analýzu širokého spektra látek a procesů. V tomto obsáhlém průvodci se ponoříme do teoretických základů elektrochemie, detailně prozkoumáme jednotlivé elektrochemické techniky, osvětlíme jejich rozmanité aplikace a představíme nejnovější trendy a inovace v této dynamicky se rozvíjející oblasti.
Historický Vývoj Elektrochemických Metod

Historie elektrochemie sahá až do konce 18. století, kdy Luigi Galvani a Alessandro Volta položili základy pro pochopení elektrických jevů spojených s chemickými reakcemi. První galvanické články a Volův sloup představovaly revoluční objevy, které otevřely dveře k systematickému studiu elektrochemie. V 19. století Michael Faraday formuloval zákony elektrolýzy, které definovaly kvantitativní vztahy mezi elektrickým proudem a množstvím vyloučené látky. Postupný vývoj elektrod, měřicích přístrojů a teoretických konceptů vedl k postupnému formování moderních elektrochemických metod měření, které dnes hrají klíčovou roli ve vědě, průmyslu a medicíně.

Základní Principy Elektrochemie
Srdcem elektrochemických metod měření jsou elektrochemické reakce, které zahrnují přenos elektronů mezi elektrodou a látkami v roztoku (elektrolytu). Tyto reakce mohou být buď redoxní (oxidačně-redukční), kde dochází ke změně oxidačního stavu atomů, iontů nebo molekul, nebo mohou zahrnovat fázové změny nebo adsorpci. Na povrchu elektrody se vytváří elektrická dvojvrstva, která ovlivňuje rychlost a mechanismus elektrochemických reakcí. Klíčovými parametry v elektrochemii jsou potenciál elektrody, který určuje energetickou úroveň elektronů na elektrodě, a proud, který je mírou rychlosti elektrochemické reakce. Vztah mezi potenciálem a proudem je charakteristický pro daný elektrochemický systém a je základem pro většinu elektrochemických měřicích technik.
Elektrody a Elektrodové Reakce
Elektrody jsou vodivé materiály, které slouží jako rozhraní pro přenos elektronů mezi vnějším obvodem a elektrolytem. Mohou být vyrobeny z různých materiálů, jako jsou kovy (platina, zlato, stříbro, rtuť), uhlíkové materiály (grafit, skelněný uhlík) nebo polovodiče. Podle své funkce se elektrody dělí na pracovní elektrody, na kterých probíhá studovaná elektrochemická reakce, referentní elektrody, které udržují konstantní a známý potenciál, a pomocné elektrody, které uzavírají elektrický obvod. Elektrodové reakce mohou být anodické (oxidace, ztráta elektronů) nebo katodické (redukce, zisk elektronů). Rychlost těchto reakcí je ovlivněna mnoha faktory, včetně potenciálu elektrody, koncentrace reaktantů, teploty a přítomnosti katalyzátorů.
Elektrolyty a Iontová Vodivost
Elektrolyty jsou roztoky, taveniny nebo pevné látky, které obsahují volné ionty a umožňují tak vedení elektrického proudu. Nejčastěji se používají vodné roztoky solí, kyselin nebo zásad. Iontová vodivost elektrolytu závisí na koncentraci iontů, jejich náboji, velikosti, pohyblivosti a viskozitě rozpouštědla. Přenos náboje v elektrolytu probíhá migrací iontů pod vlivem elektrického pole. Pro správnou funkci elektrochemického článku je nezbytné zajistit dostatečnou vodivost elektrolytu, aby se minimalizoval odpor a umožnil efektivní průchod proudu.

Elektrická Dvojvrstva
Na rozhraní elektrody a elektrolytu se vytváří elektrická dvojvrstva, což je tenká vrstva s nerovnoměrným rozložením elektrického náboje. Tato vrstva se skládá z vrstvy pevného náboje na povrchu elektrody a vrstvy iontů v elektrolytu, které jsou přitahovány k povrchu elektrody opačným nábojem. Struktura elektrické dvojvrstvy je komplexní a zahrnuje Helmholtzovu vrstvu (vnitřní a vnější) a Gouyho-Chapmanovu difuzní vrstvu. Elektrická dvojvrstva hraje klíčovou roli v elektrochemických procesech, ovlivňuje rychlost přenosu elektronů, adsorpci látek na povrchu elektrody a kapacitní chování elektrochemického systému.
Přehled Základních Elektrochemických Technik
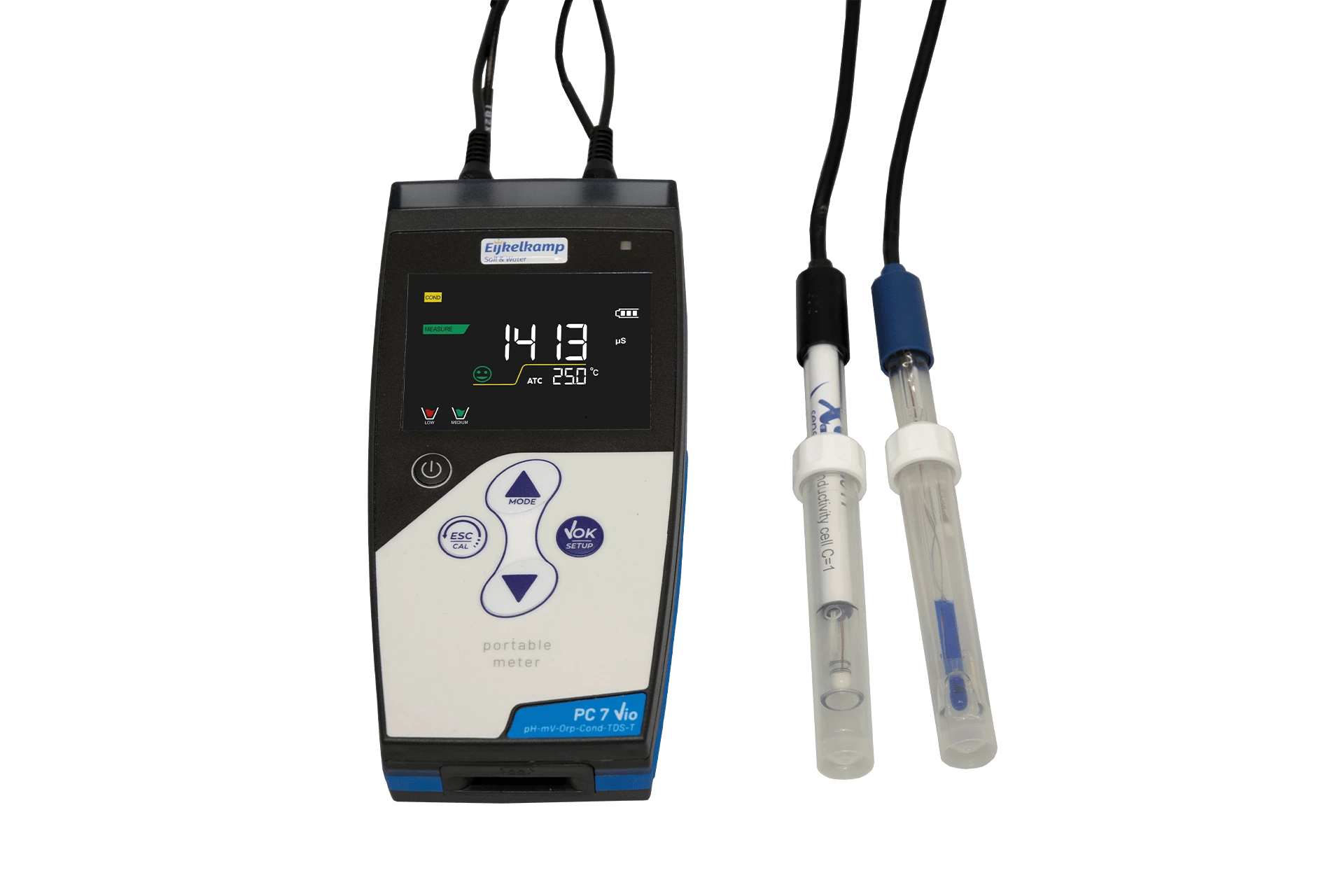
Elektrochemické metody měření zahrnují širokou škálu technik, které se liší způsobem řízení potenciálu nebo proudu a měřením odezvy systému. Mezi nejvýznamnější techniky patří voltametrie, polarografie, potenciometrie, amperometrie, konduktometrie a elektrochemická impedanční spektroskopie (EIS). Každá z těchto technik poskytuje specifické informace o studovaném elektrochemickém systému a je vhodná pro různé typy analýz a aplikací.
Voltametrie: Dynamická Analýza Elektrochemických Procesů
Voltametrie je dynamická elektrochemická technika, při které se mění potenciál pracovní elektrody v čase a současně se měří výsledný proud. Závislost proudu na potenciálu (voltamogram) poskytuje informace o redoxních potenciálech, rychlosti přenosu elektronů a mechanismu elektrochemických reakcí. Existuje mnoho variant voltametrie, včetně cyklické voltametrie (CV), lineární sweep voltametrie (LSV), diferenční pulzní voltametrie (DPV) a square wave voltametrie (SWV). Cyklická voltametrie je široce používána pro studium redoxních procesů a mechanismů reakcí, zatímco pulzní techniky nabízejí vyšší citlivost a rozlišení pro kvantitativní analýzu.
Cyklická Voltametrie (CV)

Cyklická voltametrie je výkonná elektrochemická technika, při které se potenciál pracovní elektrody lineárně mění mezi dvěma krajními hodnotami rychlostí skenování a poté se vrací zpět k počáteční hodnotě. Získaný voltamogram (závislost proudu na potenciálu) má charakteristický tvar s anodickými a katodickými píky, jejichž poloha a velikost poskytují cenné informace o redoxních potenciálech, reverzibilitě reakcí a kinetických parametrech elektrochemických procesů. Cyklická voltametrie je široce používána pro identifikaci elektroaktivních druhů, studium mechanismů elektrochemických reakcí, hodnocení stability meziproduktů a charakterizaci nových materiálů pro elektrody.
Lineární Sweep Voltametrie (LSV)
Lineární sweep voltametrie je podobná cyklické voltametrii, ale potenciál se mění pouze v jednom směru, od počáteční k koncové hodnotě. Tato technika se často používá pro stanovení nástupních potenciálů elektrochemických reakcí a pro kvantitativní analýzu látek, které podléhají elektrochemické oxidaci nebo redukci. Tvar voltamogramu a výška píku proudu jsou úměrné koncentraci elektroaktivní látky.
Diferenční Pulzní Voltametrie (DPV)
Diferenční pulzní voltametrie je vysoce citlivá technika, která využívá sérii potenciálových pulzů superponovaných na lineárně se měnící základní potenciál. Proud se měří těsně před aplikací pulzu a na konci pulzu. Rozdíl těchto dvou proudových hodnot se vynáší proti základnímu potenciálu. Tato metoda výrazně snižuje vliv kapacitního proudu a zvyšuje citlivost a rozlišení, což ji činí vhodnou pro analýzu stopových množství látek a pro rozlišení elektrochemicky podobných sloučenin.
Square Wave Voltametrie (SWV)
Square wave voltametrie je další pulzní technika, která kombinuje rychlost lineární sweep voltametrie s vysokou citlivostí diferenční pulzní voltametrie. Potenciál se mění ve tvaru čtvercové vlny superponované na základní potenciál. Proud se měří na konci každého kroku potenciálu v obou směrech. Tato technika je rychlá a citlivá a nachází uplatnění v rychlé kvantitativní analýze a ve studiu kinetiky elektrochemických reakcí.
Polarografie: Analýza s Rtuťovou Kapkovou Elektrodou
Polarografie je speciální typ voltametrie, která využívá rtuťovou kapkovou elektrodu (DME) nebo visící rtuťovou kapkovou elektrodu (HMDE) jako pracovní elektrodu. Kontinuální obnova povrchu elektrody zajišťuje vysokou citlivost a reprodukovatelnost měření. Polarografie a její moderní varianty, jako je normální pulzní polarografie (NPP) a diferenční pulzní polarografie (DPP), se tradičně používaly pro analýzu iontů kovů a organických látek v roztoku. Díky své citlivosti je polarografie stále relevantní v mnoha oblastech, včetně analýzy životního prostředí a farmaceutického průmyslu.
Potenciometrie: Měření Rovnovážného Potenciálu
Potenciometrie je elektrochemická technika, při které se měří potenciál elektrody v rovnovážném stavu (při nulovém proudu) v závislosti na koncentraci analytu. Využívá se Nernstovy rovnice, která popisuje vztah mezi potenciálem elektrody a koncentrací iontů v roztoku. Iontově selektivní elektrody (ISE) jsou speciální typy elektrod, které reagují selektivně na přítomnost určitých iontů. Potenciometrie se široce používá pro stanovení pH (pH metry), měření koncentrací specifických iontů (např. K+, Na+, Ca2+, Cl-) v různých matricích a pro potenciometrické titrace.
Iontově Selektivní Elektrody (ISE)
Iontově selektivní elektrody (ISE) jsou senzory, které vykazují selektivní odezvu na přítomnost specifických iontů v roztoku. Jejich membrána obsahuje látku, která interaguje specificky s cílovým iontem, což vede k vytvoření potenciálového rozdílu úměrného logaritmu aktivity (přibližně koncentrace) tohoto iontu. Existují různé typy ISE, včetně skleněných elektrod (pro H+, Na+, Li+), membránových elektrod (pro Ca2+, K+, Cl-, NO3-), krystalových elektrod (pro F-, S2-) a plynových senzorů (pro NH3, CO2). ISE jsou široce používány v analýze životního prostředí, klinické chemii, potravinářském průmyslu a v monitorování průmyslových procesů.
Potenciometrické Titrace
Potenciometrické titrace jsou analytické metody, při kterých se sleduje změna potenciálu indikační elektrody v závislosti na objemu přidaného titračního činidla. Bod ekvivalence titrace je indikován prudkou změnou potenciálu. Potenciometrické titrace se používají pro stanovení koncentrace kyselin a zásad, redoxních reakcí, srážecích reakcí a komplexotvorných reakcí. Jsou zvláště užitečné pro analýzu barevných nebo zakalených roztoků, kde vizuální indikace bodu ekvivalence je obtížná.

Amperometrie: Měření Proudu při Konstantním Potenciálu
Amperometrie je elektrochemická technika, při které se měří proud protékající elektrochemickým článkem při konstantním aplikovaném potenciálu. Velikost proudu je úměrná rychlosti elektrochemické reakce, která je zase závislá na koncentraci elektroaktivní látky. Amperometrie se často používá v elektrochemických senzorech pro detekci a kvantifikaci specifických analytů, například glukózy (glukózové senzory), kyslíku (Clarkovy elektrody) a dalších biologicky významných látek. Chronoamperometrie je varianta amperometrie, při které se sleduje časová závislost proudu po skokové změně potenciálu, a používá se pro studium kinetiky elektrodových reakcí a difuzních procesů.
Elektrochemické Senzory
Elektrochemické senzory využívají principů amperometrie, potenciometrie nebo konduktometrie pro detekci a měření koncentrace specifických látek. Skládají se z elektrody (nebo soustavy elektrod) v kontaktu s analyzovaným vzorkem a převodníku, který převádí elektrochemický signál na měřitelnou veličinu (proud, potenciál, vodivost). Elektrochemické senzory se vyznačují vysokou citlivostí, selektivitou a možností miniaturizace, což je činí ideálními pro monitorování životního prostředí, klinickou diagnostiku, průmyslové procesy a potravinářskou analýzu.
Bioelektrochemie a Biosenzory
Bioelektrochemie je interdisciplinární obor, který se zabývá studiem elektrochemických procesů v biologických systémech a vývojem biosenzorů. Biosenzory jsou analytická zařízení, která kombinují biologický rozpoznávací prvek (např. enzym, protilátku, DNA) s elektrochemickým převodníkem pro specifickou a citlivou detekci biologických molekul. Elektrochemické biosenz